上了天班,已睏...![]() 。好不容易撐到星期四了,又是分享文章的時刻,今天,還是來聊COVID-19跟間質幹細胞。
。好不容易撐到星期四了,又是分享文章的時刻,今天,還是來聊COVID-19跟間質幹細胞。
大家可能還不知道,近幾年幹細胞的發展十分迅速,以前存幹細胞像在買保險,大概率用不到,但不幸要用時至少能得救;而現在細胞治療已隨著醫學進步跟法規開放,可以用在越來越多疾病,儲存幹細胞更像是買個未來治療的早鳥價,到頭終有用得上的一刻。
像是急性呼吸窘迫症(acute respiratory distress syndrome, ARDS),這兩年,有許多感染COVID-19的患者,因併發ARDS而導致死亡,而間質幹細胞(Mesenchymal stem cells, MSCs)就成為挽救性命的其中一個機會,許多臨床研究顯示,MSCs 輸注可以改善病人的ARDS,而科學家也對其機制展開進一步研究。
MSCs的免疫調節特性對ARDS的幫助
嗜中性球(neutrophil)可藉由釋放某些促發炎因子而造成肺部組織的損傷,因此嗜中性球被認為是造成ARDS的主因之一。嗜中性球會遷移至上皮細胞,釋放像是蛋白酶、嗜中性球細胞外陷阱(neutrophil extracellular traps, NETs)和活性氧物質(Reactive oxygen species, ROS)來消除病原菌。而ROS過度表現的時候我們會稱為「氧化爆起作用(oxidative burst)」或是「呼吸爆(respiratory burst)」,這不單單會消除病原菌,也會傷害肺血管內皮細胞和肺泡上皮細胞。已有臨床前實驗測試,不管是輸注小鼠脂肪間質幹細胞或是人類骨髓間質幹細胞可以抑制嗜中性球的活化並降低ROS。另外,在人類和小鼠的骨髓間質幹細胞的研究中,MSCs的培養介質透過抑制核因子活化B細胞κ輕鏈增強子nuclear factor kappa-B, NF-κB)信號傳導路徑而促進嗜中性球的細胞凋亡,這樣的結果顯示MSCs的旁分泌(paracrine function)可能在肺部修復扮演重要的角色。
巨噬細胞(Macrophages)會在ARDS的患者中呈現M1型與M2型巨噬細胞之間的動態平衡,MSCs透過調節巨噬細胞的極化作用使M2型巨噬細胞比例增高,進而減緩發炎反應。而在ARDS的患者中有發現,肺部的成熟樹突細胞(mature dendritic cells, mDCs)數量會增多並加劇肺部的發炎反應。有研究指出人類臍帶間質幹細胞藉由旁分泌肝細胞生長因子(paracrine hepatocyte growth factor, HGF)可以活化AKT信號通路誘導mDCs分化為調節數突細胞(regulatory dendritic cells, DCregs),抑制發炎細胞因子分泌進而減輕小鼠模型中的肺部損傷。最後,有研究以小鼠骨髓間質幹細胞進行試驗,發現可以調節T細胞進入輔助T細胞17(Th17)和調節T細胞(Treg)的極化,降低Th17/Treg的比值達到平衡體內和體外的發炎因子作用。
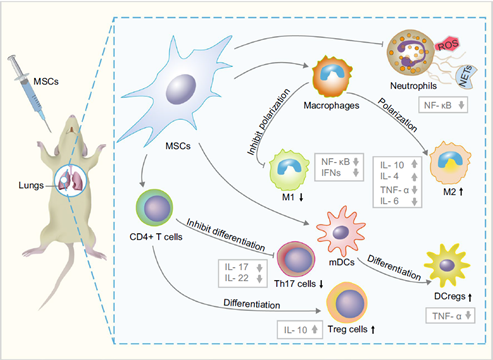
圖1、MSCs於ARDS患者中的免疫調節特性
DCregs:調節樹突細胞;mDCs:成熟樹突細胞;ROS:活性氧;NETs 嗜中性球包外陷阱;Th17:輔助T細胞17;Treg cells:調節T細胞;M1:M1 巨噬細胞;M2:M2 巨噬細胞
MSC的旁分泌功能在維持肺泡上皮和內皮屏障中的作用
在體外實驗,中人類MSCs可以分泌HGF和血管內皮生長因子(vascular endothelial growth factor, VEGF)通過活化Rac1信號通路來保護細胞旁和跨細胞內皮屏障的協同作用。當第二型肺泡表皮細胞(type II alveolar epithelial cells, AEC II)暴露在發炎因子的損害時,MSCs會經由旁分泌角質形成細胞生長因子(keratinocyte growth factor, KGF)和血管生成素-1 (angiopoietin-1)來修復上皮細胞的通透性。
MSC衍生的外泌體(exosome)在ARDS中的治療潛力
研究指出,MSC衍生的外泌體可攜帶miR-124-3p與miR-451來抑制TLR4的表現從而限制TLR4/NF-κB信號通路所引起的發炎反應。小鼠骨髓間質幹細胞所衍生的外泌體也發現帶有miR-21-5p,可抑制肺部上皮細胞的細胞凋亡;藉由增加miR30-3p的表現來抑制急性發炎期的反應物-血清澱粉蛋白3 (serum amyloid A3, SAA3),達到保護AEC II的作用。

圖2、由MSC所衍生的旁分泌因子(paracrine factors)對ARDS的效果
MSC對COVID-19患者的治療潛力
COVID-19的重症患者常伴隨著嚴重的肺炎和ARDS,而目前對於COVID-19的病理機制推測有以下五點:1. SARS-CoV-2對上皮細胞的胞毒性、2. SARS-CoV-2對血官收縮素轉化酶2 (angiotensin-converting enzyme 2, ACE2) 的交互作用導致腎素-血管收縮素-醛固酮系統(renin–angiotensin–aldosterone system)失調、3. 細胞因子(cytokines)和趨化因子(chemokines)所導致的過度發炎及免疫反應失調、4. 內皮細胞損傷和血栓發炎、5. 肺部間質增厚和纖維化。
已有許多臨床前及臨床研究指出MSCs擁有組織再生的能力,並且具備抑制免疫風暴(cytokine storm)和肺纖維化(pulmonary fibrosis)的潛力。在一項有關COVID-19的臨床二期實驗中(隨機,雙盲,安慰劑對照,臍帶間質幹細胞組為n = 65,安慰劑組為n = 35),進行三次間質幹細胞的輸注(第0、3及6天,每次4 x 107個細胞)來治療具有嚴重肺損傷的COVID-19患者,在觀察28天後發現臍帶間質幹細胞組對於肺功能具有顯著的改善。
在COVID-19患者所導致的ARDS通常與免疫風暴有關,而其中嗜中性球是SARS-CoV-2是導致器官損害和死亡的關鍵介質。COVID-19患者中也觀察到樹突細胞、Th17/Treg的失調,還有發炎反應及免疫細胞過渡活化而導致細胞因子過度表現。而利用MSCs免疫調節的特性來治療ARDS的機制正好與COVID-19所造成的病徵相匹配,因此以MSCs進行的細胞治療可被視為一個對於COVID-19的新療法。
結論
MSCs有幾種潛在機制有助於治療ARDS,包括調節免疫及發炎細胞、旁分泌作用、有益外泌體的釋放和減輕肺纖維化的效果。在COVID-19臨床試驗的結果證明了MSCs的安全性和療效,但仍需要在更長期、更大規模的試驗中,針對ARDS(尤其是COVID-19患者)的治療狀況進行追蹤,來確定以MSCs進行細胞治療的最佳細胞來源、劑量和方式。

圖3、具ARDS之COVID-19患者肺部的病理變化與相對應的MSC特性
資料來源
https://translational-medicine.biomedcentral.com/articles/10.1186/s12967-021-02862-x



 留言列表
留言列表
